
더 궁금하신 부모님들을 위한
로타바이러스 백신 원리
추가 설명
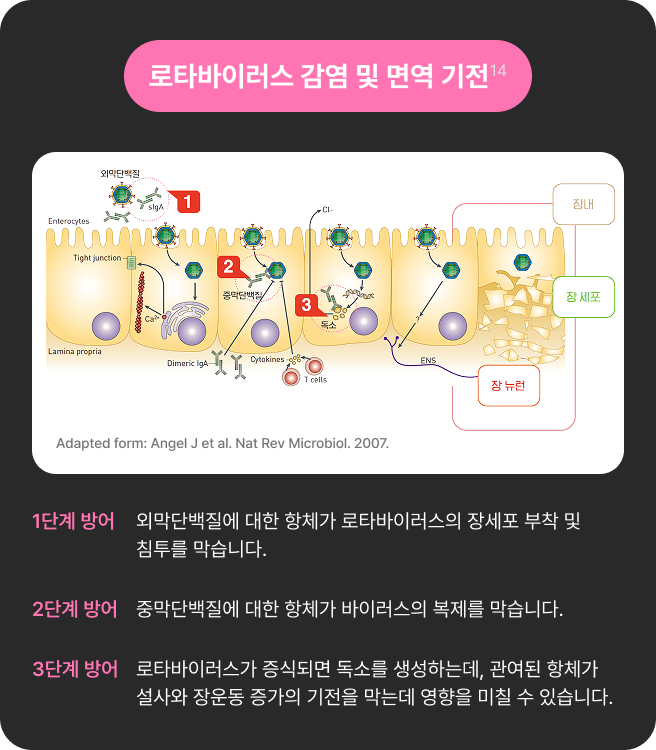
로타바이러스 질환 발생 원리
인간 장 세포로 로타바이러스가 침투하면서
독소를
배출하면, 로타장염이 발생합니다.4,14
로타바이러스 백신 예방 원리
로타바이러스 백신은 자연 감염을 재현하는데, 이때
아기의 몸에서는
로타바이러스에 대한 항체를
생성하여 면역을 얻습니다.10,11,14
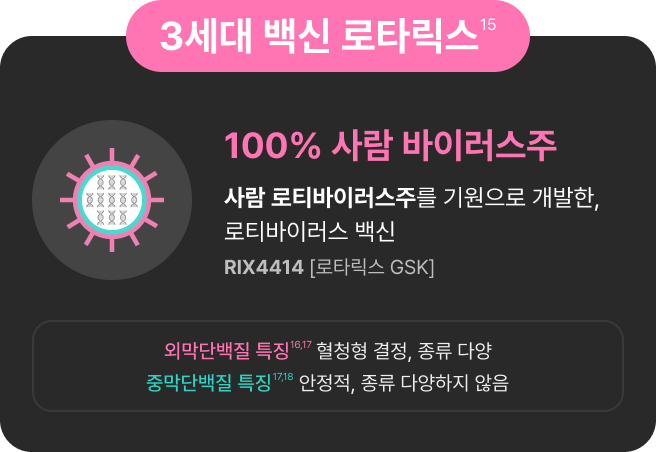
100% 사람로타바이러스주로
로타릭스 100% 사람 바이러스 주로 개발되어 로타바이러스
자연감염 과정을 재현하는 원리로 개발되었습니다.2,10,11
이 때문에, 감염의 3가지 단계에서 모두 면역을 활성화하고,
5가지 주요 혈청형에 대한 교차면역 효과를 제공합니다.12,14
또한 인간 장에서 복제가 잘 되며, 2회 접종만으로
면역을 형성하고 접종 완료 가능합니다.2
중막단백질 VP6에 대한 항체는
교차면역을 형성합니다.17-19
일반적인 로타바이러스§ 주에서
공유되는 항원17
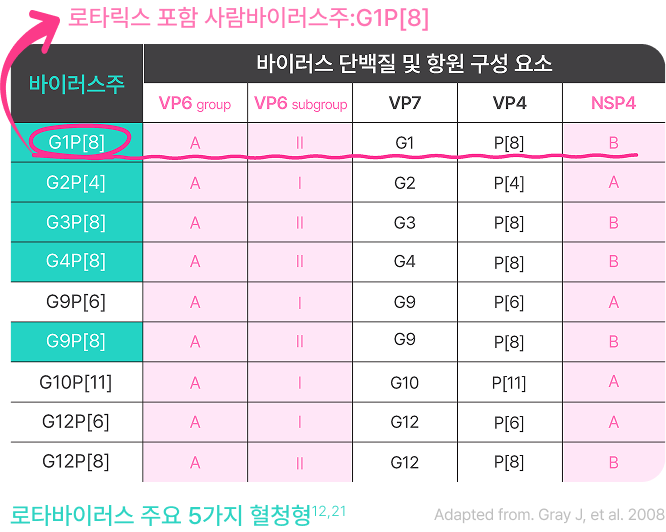
외막단백질 VP4, VP7과 달리, 중막단백질 VP6와
독소 NSP4는 다양하지 않으며,
중막단백질 VP6에 대한 항체가 교차면역을 형성합니다.19
VP, viral protein; NSP4, nonstructural protein 4
§로타바이러스는 내막, 중막(VP6), 외막(VP4, VP7)으로 이루어져 있으며,
외막에 의해 혈청형이 결정됩니다.16,22 중막단백질 VP6에 대한 항체는
로타바이러스 주 간 교차 면역 효과를 보입니다.19
로타바이러스에 처음 감염 시 특정 혈청형에 대한
중화항체가 생성되며, 이후 반복 감염을 통해
다른 혈청형에 대한 방어력도 형성됩니다.9


예방접종 주의사항20
접종 전
접종 후
기본 정보
제품 정보
효능•효과
용법•용량
기본 정보
︎Safety Information
1. 다음 환자에는 투여하지 말 것.
1) 이 백신의 성분에 대하여 과민반응이 있는 자
2) 이전에 로타바이러스 백신 투여 후 과민반응을 나타낸 자
3) 장중첩증의 병력이 있는 자
급성 중증 열성 질환자는 이 백신의 투여를 연기하여야 한다. 그러나, 경미한 감염(예. 감기)은 투여금기가 아니다.
6) 설사 또는 구토를 하는 경우 이 백신의 투여를 연기하여야 한다.
7) 중증혼합면역결핍증(SCID)이 있는 자
2. 다음 환자에는 신중히 투여할 것.
위장관 질환 또는 성장지연이 있는 영아에 대한 안전성 및 유효성 자료가 없으므로 이들 영아의 경우, 백신 투여 지연이 더 중대한 위험을 수반한다고 의사가 판단하면, 이 백신의 접종을 신중히 고려해 볼 수 있다.
면역이 결핍된 자(예, 악성 종양환자나 다른 면역 저하 환자, 면역억제요법을
받고 있는 자 등)와 접촉하는 경우에는 이 백신을 주의하여 투여한다.
면역이 억제된 영아(면역결핍증이 있는 영아, 면역억제요법을
받고 있는 영아, 자궁내에서 면역억제제 치료에 노출된 영아 포함)의 경우,
잠재적인 유익성과 위험성을 신중히 고려하여 이 백신을 투여한다.
3. 이상사례
총 4개의 임상시험에서, 로타릭스 액상제형 약 3800 도즈가
약 1900명의 영아에게 투여되었다.
이 들 임상시험은 액상제형의 안전성 프로파일이 동결건조제형과
유사함을 보여주었다. 총 23개의 임상시험에서, 약 51,000명의
영아에게 동결건조제형 또는 액상제형의 이 백 신 약 106,000
도즈를
투여하였다. 3개의 위약대조 임상시험에서, 이 백신을
단독으로 투여하였다.(기본 소아 백신과 동시에 투여되지 않았다.)
명시된 반응(백신 투여 후 8 일 동안 수집됨), 설사, 구토, 식욕부진,
발열, 보챔 및
기침/콧물의 발생률 및 중증도는 이 백신 투여군과
위약 투여군 간에 유의하게 다르지 않았다.
이러한 반응들에 대한 발생 률 또는 중증도는 2차 투여시
증가하지 않았다.
동결건조제형 또는 액상제형의 이 백신을 기본 소아백신과 동시
투여한 임상시험을 포함하는 17개의 위약대조 임상시험을 통합
분석한 결과, 다음의 이상반응(백신 투여 후 31일 동안 수집됨)
이 백신 투여와 관련이 있을 것으로 여겨졌다.
위장관계 이상 - 흔하게: 설사 - 흔하지 않게: 고창, 복통
피부 및 피하조직 이상 - 흔하지 않게: 피부염
전신 이상 및 투여부위 - 흔하게: 보챔
ㆍ63,225명의 피험자가 참여한
라틴아메리카와 핀란드에서의 대규모 안전성 임상시험에서
장중첩증의 위험을 평가하였다. 다음과 같이, 이 백신 투여군에서의
장중첩증 위험도는 위약군과 비교하였을 때 증가하지 않았다.
-1차 접종 후 31일 이내의 장중첩증: 로타릭스(31,673명) 1명,
위약(31,552명) 2명, 상대적 위험도 (95% 신뢰구간) 0.50
(0.07;3.80)-2차 접종 후 31일 이내의 장중첩증: 로타릭스(31,673명)
5명, 위약(31,552 명) 5명,
상대적 위험도 (95% 신뢰구간) 0.99
(0.31;3.21)
ㆍ조산아에서의 안전성: 임상시험에서 1,009명의
조산아에게 로타릭스 동결건조제형 백신 또는 위약을 투여하였다.
(재태기간이 27-30주인 조산아 198명, 재태기간이 31-36주인
조산아 801명). 생후 6주 이후에 1차 투여를 하였다. 중대한
이상반응은 이 백신 투여군의 5.1%, 위약 투여 군의 6.8%에서
관찰되었다. 이 밖의 이상반응의 발생률은 이 백신 투여군과 위약
투여군 간에 유사했다.
장중첩증 사례는 보고되지 않았다.
[참조: 로타릭스 국내제품설명서]
︎References
부작용이 있을 수 있으니 ‘사용상의 주의사항’을 잘 읽고,
의사・약사와 상의하십시오. 질환과 제품에 대한 자세한 사항은
의약사와 상담하세요.
GSK 제품 사용 중 발생한 이상사례(부작용)는 080-901-4100
또는 koreasafetyreporting.co.kr으로 보고해 주시기 바랍니다.